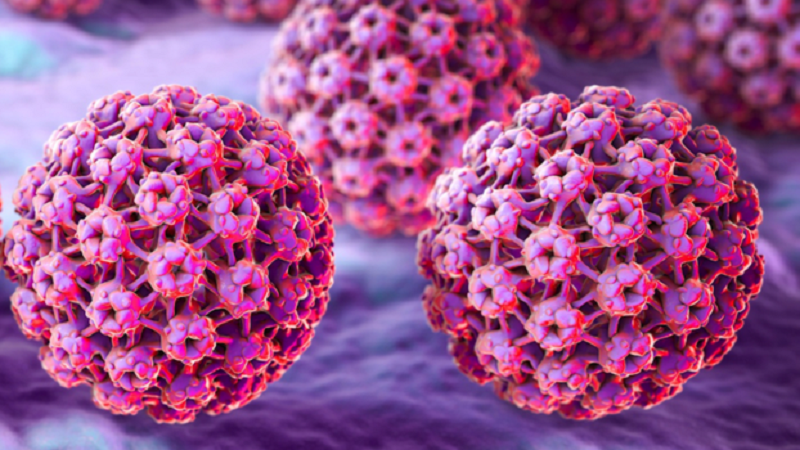
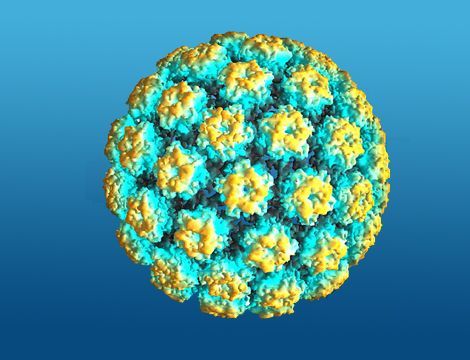
l Papilloma Virus Umano o HPV (acronimo di "Human Papilloma Virus" ) è un virus appartenente alla famiglia delle Papillomaviridae e al genere Papillomavirus.
Esistono numerosi ceppi di Papilloma Virus, attualmente ne sono stati identificati oltre 120, ma si presume che il numero di genotipi sia in continua crescita, classificati in 16 gruppi designati progressivamente con le lettere da A a P in base alle omologie di sequenza del DNA. È possibile classificare i papilloma virus in cutanei (prevalentemente HPV di tipo Beta) e mucosi (prevalentemente di tipo Alfa) in base al sito d’azione su cui esercitano il loro potere patogeno. Ampiamente distribuiti nella popolazione, sono virus a trasmissione prevalentemente sessuale.
Epidemiologia
L’infezione da Hpv è estremamente frequente nella popolazione: si stima, infatti, che almeno il 75% delle donne sessualmente attive si infetti nel corso della propria vita con un virus Hpv di qualunque tipo, e che oltre il 50% si infetti con un tipo ad alto rischio oncogeno.
In Italia, studi condotti in donne di età tra 17 e 70 anni, in occasione di controlli ginecologici di routine o di programmi di screening organizzato, mostrano una prevalenza per qualunque tipo di Hpv compresa tra 7 e 16%. La prevalenza aumenta al 35-54% in caso di donne con diagnosi di citologia anormale, per raggiungere il 96% in caso di displasia severa o oltre. La prevalenza delle infezioni da Hpv varia con l’età: è più elevata nelle giovani donne sessualmente attive, mentre un secondo picco di prevalenza si nota nelle donne intorno alla menopausa o dopo. Uno studio condotto nell’Italia settentrionale in donne tra 25 e 70 anni ha mostrato come la prevalenza diminuisca dal 13-14% nella fascia di età 25-39 anni, all’11% nelle donne tra 40 e 44 anni, e al 5% nelle donne oltre i 44 anni.(1)
Struttura:
Gli HPV sono virus nudi (senza pericapside), possiedono un capside icosaedrico con un diametro attorno a 50 nm, formato da 72 capsomeri che possono essere pentameri o esameri. Ciascun capsomero dà origine a una protuberanza che ha una forma simile a una stella a cinque punte con un canale al centro. Il capside contiene un genoma costituito da DNA circolare a doppio filamento lungo 8 Kb che codifica per otto geni precoci (early, da E1 a E8) e due geni tardivi (late, L1 e L2). A monte dei geni precoci c'è una regione regolatrice contenente l'origine della replicazione, alcune sequenze regolanti la trascrizione e una sequenza N-terminale comune a tutte le proteine precoci.(2) Mentre le tardive sono le proteine strutturali, che associandosi tra loro formano la struttura icosaedrica del capside virale, le proteine precoci servono a modificare il metabolismo della cellula infettata per metterlo al servizio dell'HPV, e più specificatamente:
• La proteina E1 consente la replicazione episomale, con attività di elicasi
• La proteina E2 gioca un ruolo fondamentale nella regolazione della trascrizione virale e nella replicazione del DNA virale. In particolare la trascrizione di E2 inibisce E6 ed E7; quando il DNA di HPV si integra con il genoma umano si ha la rottura delle sequenze geniche di E2, con soppressione dell'inibizione nei confronti di E6 ed E7.(3)
• La proteina E4 è espressa nelle fasi tardive dell'infezione ed è molto importante nella maturazione e proliferazione virale. È in grado di legarsi alle proteine citoscheletriche, provocando la deformazione delle cellule infettate (coilocitosi).
• La proteina E5 inibisce l'apoptosi e blocca l'esposizione dei complessi di istocompatibilità di tipo I e II, evitando la risposta cellulare T mediata.
• La proteina E6 si lega a p53, interferendo con la riparazione del DNA e con l'innesco dell'apoptosi.
• La proteina E7 si lega alla proteina del retinoblastoma (Rb), impedendo il blocco del ciclo cellulare.(4)(5)
Proteine oncogene:
Le proteine precoci del virus hanno lo scopo di favorire la crescita e la divisione della cellula; l'HPV può infatti replicare solo nelle cellule in replicazione, in quanto non codifica per una sua DNA polimerasi e ha bisogno della polimerasi della cellula ospite, che viene sintetizzata nelle cellule in attiva divisione. Le cellule bersaglio del virus sono la cute e le mucose, due tessuti che si rigenerano in continuazione. In virtù delle loro proprietà leganti ed inattivanti oncosoppressori come p53 e Rb, le proteine codificate dal genoma virale promuovono un'intensa replicazione cellulare che esita verso la formazione di papillomi, condilomi acuminati, verruche e carcinomi, a seconda del tessuto infettato.
E’ ormai ampiamente dimostrato dall’evidenza scientifica che 12 tipi di Papilloma virus, definiti “ad alto rischio”, HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 e 59, sono i responsabili della maggioranza di carcinomi della cervice uterina, dei quali il 16 e il 18 in assoluto i più frequenti. Provengono tutti dalla famiglia degli alfa-Papillomaviridae e sono classificati come 1A carcinogenetici. Nuovi studi hanno però evidenziato altri 7 tipi, HPV 26, 53, 66, 67, 68, 70 e 73, riscontrati in rari casi di Ca alla cervice, classificati, perciò, come 2B (possibile carcinogenicità).(6)
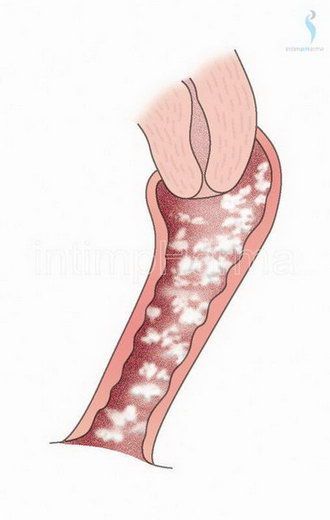
Gli altri tipi di HPV,6, 7, 11, 42, 43, 44, 46, sono definiti “a basso rischio”, causa di verruche cutanee, condilomatosi genitali e papillomatosi ricorrenti respiratorie. Inducono la crescita degli strati basale e spinoso dell'epidermide (acantosi) o dello strato superficiale della mucosa, dando origine, a seconda del luogo dell'infezione, a verruche nella cute o a papillomi nelle mucose. I condilomi sono delle escrescenze mucose di tipo verrucoso che colpiscono di preferenza le zone genitali, sia nel maschio (glande, corpo del pene, scroto e ano) che nella femmina (perineo, vulva, vagina e cervice uterina).
Comunemente considerati non pericolosi, in realtà esistono numerosi studi che evidenziano come gli stessi siano stati trovati in neoplasie dell’epitelio faringeo, laringeo, esofageo e in carcinomi ano/genitali a cellule squamose.(8)(9)/10)
HPV e risposta immunitaria:
La infezione da HPV, sebbene generi una risposta anticorpale, costituisce un bersaglio sfuggevole per il sistema immunitario e solitamente le risposte immunitarie sono deboli. Numerosi meccanismi sono coinvolti e contribuiscono a tale evasione:
1) l’ HPV non è citopatico, ossia i virus non determinano lisi cellulare come ad esempio gli herpesvirus; causano proliferazione cellulare piuttosto che distruzione cellulare e come tali non inducono una risposta infiammatoria.
2) La fase viremica dell’infezione è sostanzialmente irrilevante ed analisi effettuate su campioni sierologici di donne HPV positive o portatrici di lesioni cervicali HPV correlate, hanno confermato che nel 20-50% dei casi non sono raggiunti livelli anticorpali dosabili. Il virus penetra nell’epitelio generalmente tramite una soluzione di continuità della cute e quindi infetta le cellule basali e parabasali replicandosi nei loro nuclei.
La maturazione dell’epitelio porta in superficie le cellule contenenti il virus, che divengono a loro volta infettanti. Il tempo che generalmente intercorre tra il momento dell’infezione ed il rilascio delle cellule replicanti il virus (infettanti) è di circa tre settimane. Il periodo invece intercorrente tra l’infezione e la comparsa delle prime lesioni può variare da alcune settimane a qualche mese
3) Il fatto che l’ HPV infetti solo le cellule epiteliali riduce le capacità del sistema immunitario. I virioni completi di HPV si trovano solo nelle cellule squamose completamente differenziate, a livello degli strati più esterni dell'epitelio genitale, separati da vari strati di epitelio mucoso dai centri germinativi linfocitari presenti nella sottomucosa ed implicati nel generare la riposta immunitaria.
4) l’HPV impedisce il riconoscimento da parte del sistema immunitario innato mediante il blocco della produzione di interferoni per garantire la sua replicazione. Questo è ottenuto mediante la produzione delle due proteine precoci E6 ed E7, che si legano ed inattivano gli intermediari nella cascata degli interferoni.(11)
5) La proteina E7 incrementa, inoltre, la produzione di IL-18BP (IL-18 binding protein), una citochina anti infiammatoria, naturale antagonista dell’IL-18, che media l’attivazione dei linfociti CD4+. Ciò comporta una riduzione dell’espressione di tali linfociti attivati. (12)
Questo fa’ sì che sia impossibile determinare un’avvenuta infezione da parte di questo virus tramite ricerche sierologiche. Le uniche metodiche in grado di farlo sono citologiche: il test di Papanicolau, comunemente noto come Pap-test, e l’HPV test.
Mentre il pap-test tradizionale si basa sull'esame microscopico di cellule epiteliali prelevate dalla cervice uterina, l'HPV Test è un'indagine molecolare che si basa sulla ricerca del DNA, dell'm-RNA o di proteine specifiche virali direttamente in queste cellule. La ricerca del DNA virale può essere effettuata anche nell'uomo su campioni di sperma ed urine o tramite tampone uretrale.
Una paziente è considerata positiva al pap-test, pertanto meritevole di ulteriori approfondimenti diagnostici (colposcopia ed eventualmente biopsia mirata), quando l'esame microscopico rileva anomalie cellulari suggestive di una possibile infezione da HPV. Durante un esame molecolare, invece, il laboratorio identifica direttamente l'infezione ricercando e tipizzando il materiale genico del virus.
Rimane ancora controversa la questione se i tipi di HPV oncogeni mostrino una persistenza di infezione superiore a quella dei non oncogeni. Ad aggiungere problematicità alla questione esiste il fatto che non c’è consenso riguardo alla definizione di infezione persistente da HPV, anche se qualche studio indica come persistente quell’infezione ritrovabile in due consecutivi prelievi a distanza di 6 mesi .(14) D’altra parte, non è chiaro, quando non si riesce più a rilevare l’HPV, se esso sia stato rimosso dall’organismo oppure sia latente nelle cellule epiteliali, a livelli non rilevabili. In questo caso, una riattivazione sarebbe possibile.
Il compianto Dr. Mario Sideri, direttore Unità preventiva ginecologica dello IEO, recentemente e prematuramente scomparso, in aperta e continua diatriba con il collega Prof. Carlo Liverani, Oncologia e Ginecologia Preventiva Clinica“L.Mangiagalli”, auspicava la sostituzione del Pap test, ritenuto ormai obsoleto, con l’HPV test, quale test di screening per la diagnosi precoce di infezione da Papilloma virus umano nelle donne in età fertile.
Questo è quanto il dr Sideri affermava:
“Dal punto di vista scientifico non ci sono dubbi: al di qua ed al di là dell’atlantico il pap test annuale non è più il punto di riferimento; la letteratura degli ultimi 10 anni parla chiaro; per quanto riguarda l’Italia tra l’altro è appena uscito il rapporto HTA sull’introduzione del test HPV al posto del pap test nello screening da parte del ministero. Ma i ginecologi sono contrari; non è che sono in dubbio, sono proprio contrari.
Andiamo a prendere i dati: il pap test perde circa il 25-30% dei CIN3. Non sono pochi, sono alcune centinaia di migliaia in Italia ogni anno su 9 milioni di pap test; non solo, ma è dimostrato che la mancata diagnosi di questi CIN3, comporta lo sviluppo di alcuni tumori, che il pap test non può identificare; neppure facendo il pap ogni 6 mesi; in IEO l’80% dei tumori che osserviamo ha un pap test negativo eseguito nell’anno precedente.
Fare il test HPV significa poter identificare le donne con HPV persistente che sono a rischio di tumore con pap negativo nonostante si controllino regolarmente. Infatti in queste donne, con HPV positivo per 12 mesi (due test a distanza di un anno) si esegue una colposcopia.
Il test HPV salva delle vite che il pap test invece perde.
Tutti avrete sentito qualche caso di tumore con pap negativo l’anno prima; certo, sono pochi: ma non così rari. Il test HPV previene questi tumori e porta un vantaggio di salute alle vostre pazienti; il test HPV è un diritto irrinunciabile delle donne”
Le argomentazioni del prof. Liverani, per contro, si basano principalmente sul rischio, con l’HPV test, di “over traitment”:
“L’uso inappropriato di questi test aumenta considerevolmente i costi, senza apportare benefici e causando potenzialmente sovratrattamenti in donne altrimenti
sane. Non solo questi potenziali sovratrattamenti possono risultare dannosi, ma
anche e soprattutto non risolvono il problema, in quanto le recidive (o forse persistenze?) saranno inevitabilmente frequenti.
L’esperienza clinica sembra dimostrare che l’efficienza diagnostica e della successiva terapia di un’eventuale lesione sono il risultato di una costanza di osservazione.
Solo apparentemente lo screening episodico risulta più efficace: occorre tenere presente che se si eseguono “n” test in una popolazione “finita” ogni “tot” anni, si rileva un maggior numero di casi inizialmente, ma il distanziamento dei successivi ricontrolli provoca sia un minor recruitment di casi persi al primo filtro, sia un mancato rilevamento di lesioni ex-novo oppure molto piccole che si sviluppano nell’intervallo. Il Pap test infatti funziona molto bene se “ripetuto”: 10 Pap test fra i 30 ed i 50 anni comportano un rischio di mancare una lesione inferiore allo 0,001%.”
La posizione del dr. Sideri sembra molto condivisibile, anche considerando il rapporto costi/benefici, dato che se venisse confermato come test di screening tra la popolazione femminile tra i 21 e i 65 anni il richiamo sarebbe di 5 anni, contro i 3 attuali del Pap-test.
Suppongo che ogni donna interessata alla sua salute preferirebbe essere a conoscenza di un’avvenuta infezione, anche in assenza di lesioni visibili, o meglio prima che le stesse si evidenzino, e sicuramente vorrebbe sapere, qualora fosse stata contagiata, se il ceppo virale è ad alto o a basso rischio di sviluppare un tumore al collo dell’utero…
In realtà l’osservazione che a noi interessa sottolineare è che, in entrambi i casi, l’esito positivo del test è seguito solo da una più attenta osservazione, in attesa di una auspicata “scomparsa” del virus nel corso del tempo, contro una non auspicata evoluzione verso lesioni conclamate. Non si può parlare di prevenzione, perché non esiste alcuna terapia, per la medicina ufficiale, se non quella ablativa.
PREVENZIONE
Oggi si fa un gran parlare di vaccino per l’HPV; da pochi anni è stato reso possibile vaccinare ragazzine di 12 anni gratuitamente con un vaccino tetravalente, contro i tipi 16, 18, 6 e 11.
Stranamente, (o per fortuna), molti pediatri di base si sono mostrati contrari e hanno dissuaso le madri dal far vaccinare le figlie adolescenti.
Senza entrare in merito agli innumerevoli studi sulla validità dello stesso(15)(16)(17) non si può fare a meno di obiettare che, a fronte di una copertura da infezioni dei quattro ceppi suddetti, esiste la seria possibilità, per le ragazze vaccinate, di essere comunque infettate da altri 24 genotipi, 10 dei quali, lo ricordiamo, sono classificati come altamente oncogeni.
Come si può parlare di “vaccinazione”, o meglio di immunizzazione,dunque?
Il sistema VAERS (Vaccine Adverse Event Report System), che raccoglie le segnalazioni di effetti indesiderati durante e dopo una vaccinazione, ha raccolto fino alla fine di febbraio 2008 più di 5.300 reazioni avverse dopo vaccinazione con il vaccino tetravalente Gardasil®, su un totale di circa 8 milioni di dosi vendute. Secondo la Ditta produttrice, il 2-4% di tutti gli effetti indesiderati del vaccino erano effetti gravi, mentre secondo i Centers for Disease Control and Prevention (CDC) questi effetti ammontavano a circa il 5%. Finora sono stati riportati 10 casi ad esito fatale tra le ragazze/donne vaccinate, ma la Ditta produttrice rassicura dicendo che “gli eventi riportati erano in linea con gli eventi attesi nella popolazione sana”.
La FDA (Food and Drug Administration) ha ricevuto anche 28 segnalazioni di aborto dopo somministrazione del vaccino Gardasil® a 77 donne in stato di gravidanza (28/77: 36%); altre 5 donne hanno registrato danni fetali gravi a carico dei loro feti. (18)
E le conseguenze, che vengono come al solito minimizzate (19), di un possibile mimetismo molecolare e conseguente comparsa di malattie autoimmuni derivanti da tale pratica??
La letteratura internazionale riporta casi di Sclerosi Multipla, Tiroiditi, LES, Uveiti, paralisi, paralisi di Bell (paralisi facciale), sindrome di Guillain Barrè, quali gravi eventi avversi neurologici associati alla vaccinazione con Gardasil. (20)(21)(22)(23)
La questione è quanto mai aperta, considerando, poi, che non esiste un follow-up a lunga distanza che dirimi i numerosi e leciti dubbi.
Un’attenzione particolare va poi riservata al ruolo di altre infezioni sessualmente trasmesse che possono incrementare il rischio di tumore della cervice tra le donne infette da HPV. La Chlamydia trachomatis, è, tra gli agenti esaminati, quella maggiormente incriminata. Studi caso-controllo effettuati negli anni scorsi, che confrontavano i casi di tumore della cervice con soggetti di controllo positivi per la presenza di DNA di HPV a rischio oncogeno, avevano riportato un rischio più elevato nelle donne positive alla Chlamydia trachomatis rispetto a quelle negative.
In un ampio studio di pool analisi, Smith et al. (2004) hanno analizzato 7 studi caso-controllo internazionali di pazienti con tumore della cervice, condotti in diversi Paesi del mondo, pubblicati nel periodo 1992-2001, in relazione al ruolo dell’infezione da Chlamydia trachomatis e rischio di tumore invasivo della cervice tenendo conto dello stato HPV delle donne. Lo studio includeva 1.238 casi e 1.100 controlli e la determinazione degli anticorpi sierici di Chlamydia trachomatis era stata condotta per mezzo della microfluorescenza. Tra i casi ed i controlli HPV DNA positivi, il rischio di tumore invasivo della cervice a cellule squamose era elevato nelle donne sieropositive alla Chlamydia trachomatis (OR=1,8; 95% CI: 1,2-2,7)
L’effetto della sieropositività alla Chlamydia trachomatis, sul rischio di tumore invasivo della cervice a cellule squamose, aumenta con l’incremento del titolo anticorpale della stessa ed era più alto nelle donne di età < 55 anni.(25)
Per quanto ci concerne sappiamo bene come la migliore prevenzione, in risposta ad un’infezione da HPV, sia esso di tipo oncogeno o no, sia la sua negativizzazione in tempi estremamente brevi, con uno o più cicli di Calcarea Carbonica, somministrata unitamente all’anti-recettore del virus, l’antiCD49d, che eliminano la positività all’HPV test nel 100% delle nostre pazienti o, in caso di condilomatosi o lesioni verrucose, di Thuya e Ac. Nitricum, che portano alla regressione delle lesioni e alla completa guarigione.
Un’eventuale co-infezione da Chlamydia trac. può essere a sua volta negativizzata con l’Acidum Nitricum associato all’AntiCD49d, dato che i due agenti infettivi utilizzano lo stesso recettore.
Abbiamo, cioè, tra le mani una potenzialità di cura che non ha pari, che farebbe risparmiare tempo e denaro alle Istituzioni e inutili ansie nonché cure invasive alle pazienti, e che sarebbe ora e opportuno diffondere e far conoscere ai nostri colleghi ginecologi e non. Le uniche a non essere contente sarebbero la Sanofi e la Merck…ma questo è un altro discorso,…..o no?
BIBLIOGRAFIA:
1- Baseman JG, Koutsky LA. The epidemiology of Human Papilloma Virus infections. J Clin Virol 2005;32(Suppl):16-24
2- Sanclemente, G. and D. K. Gill, 2002. Human papillomavirus molecular biology and pathogenesis. JEADV. 16: 231-240.
3- Bing Du Xue Bao. 2014 Mar;30(2):201-7 Research progress in roles of high-risk human papillomavirus E2 protein.
4- Collins et al., Interactions with Pocket Proteins Contribute to the Role of Human Papillomavirus Type 16 E7 in the Papillomavirus Life Cycle, Journal of virology, 79 (23), p. 14.769-80, 2005
5- Heck DV et al., Efficiency of binding the retinoblastoma protein correlates with the transforming capacity of the E7 oncoproteins of the human papillomaviruses, Proceeding of the National Academy of Sciences of the United States of America, 89 (10), p. 4442-46, 1992Heck DV et al.
6- Coll Antropol. 2014 Jun;38(2):779-86.Human papillomavirus-related diseases of the female lower genital tract: oncogenic aspects and molecular interaction.
Zekan J, Skerlev M, Mili? L, Karelovi? D
7- Bouvard V, Baan R et al; WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens-Part B: biological agents. Lancet Oncol 2009 Apr; 10(4):321-2
8- Am J Surg Pathol. 2013 Sep;37(9):1299-310. The occasional role of low-risk human papillomaviruses 6, 11, 42, 44, and 70 in anogenital carcinoma defined by laser capture microdissection/PCR methodology: results from a global study Guimerà N1, Lloveras B, Lindeman J, Alemany L, van de Sandt M, Alejo M, Hernandez-Suarez G, Bravo IG, Molijn A, Jenkins D, Cubilla A, Muñoz N, de Sanjose S, Bosch FX, Quint W
9- Int J Cancer. 2013 Nov;133(9):2253-8. Anal and perianal squamous carcinomas and high-grade intraepithelial lesions exclusively associated with "low-risk" HPV genotypes 6 and 11.
Cornall AM1, Roberts JM, Garland SM, Hillman RJ, Grulich AE, Tabrizi SN.
10- Postepy Hig Med Dosw (Online). 2013 Jul 15;67:610-6. Human papillomavirus and its influence on head and neck cancer predisposition Nelke KH1, Lysenko L, Leszczyszyn J, Gerber H.
11- Srp Arh Celok Lek. 2014 May-Jun;142(5-6):378-83.[Persistent human papillomavirus infection in the etiology of cervical carcinoma: the role of immunological, genetic, viral and cellular factors].Zivadinovi? R, Petri? A, Lili? G, Lili? V, Djordjevi? B.
12- J Virol. 2014 Apr;88(8):4173-9. Epub 2014 Jan 29. Human papillomavirus E7 oncoprotein increases production of the anti-inflammatory interleukin-18 binding protein in keratinocytes.
Richards KH1, Doble R, Wasson CW, Haider M, Blair GE, Wittmann M, Macdonald A.
13- Bethesda System: terminology for reporting results of cervical cytology. JAMA 2002;287:2114-9
14- Tsutsumi K et al., Expression of human papillomavirus (HPV) gene in HPV-positive laryngeal tumors and activity of the HPV long control region in cultured normal laryngeal epithelial cells, Nippon Jibiinkoka Gakkai Kaiho, 96(5), p. 767-73
15- Acta Obstet Gynecol Scand. 2014 Aug 21. Cell-mediated immune response: A clinical review of the therapeutic potential of HPV vaccination.
Meyer SI1, Fuglsang K, Blaakaer J.
16- Vaccine. 2014 Sep 3;32(39):5087-97. Efficacy of the HPV-16/18 vaccine: Final according to protocol results from the blinded phase of the randomized Costa Rica HPV-16/18 vaccine trial Hildesheim A1, Wacholder S2, Catteau G3, Struyf F4, Dubin G5, Herrero R6;
17- Pediatr Infect Dis J. 2014 Jun 20. Long-Term Immunogenicity and Safety of the HPV-16/18 AS04-Adjuvanted Vaccine in 10-14 Year Old Girls: Open Six-Year Follow-Up of an Initial Observer-Blinded, Randomized Trial.
Schwarz TF1, Huang LM, Lin TY, Wittermann C, Panzer F, Valencia A, Suryakiran PV, Lin L, Descamps D.
18- Gava R., Serravalle E. Vaccinare contro il Papillomavirus? Quello che dobbiamo sapere prima di decidere. Edizioni Salus Infirmorum, Padova, 2a ed., 2009.
19- Hum Vaccin Immunother. 2014 Jun 19;10(8). Sustained efficacy, immunogenicity, and safety of the HPV-16/18 AS04-adjuvanted vaccine: Final analysis of a long-term follow-up study up to 9.4 years post-vaccination.
Naud PS1, Roteli-Martins CM2, De Carvalho NS3, Teixeira JC4, de Borba PC5, Sanchez N6, Zahaf T7, Catteau G7, Geeraerts B7, Descamps D7
20- Braz J Infect Dis. 2014 Apr 27. pii: S1413-8670(14)00069-5. Safety, tolerability and side effects of human papillomavirus vaccines: a systematic quantitative review.
Gonçalves AK1, Cobucci RN2, Rodrigues HM2, de Melo AG2, Giraldo PC3
21- J Intern Med. 2014 Apr;275(4):398-408.
.Autoimmune disorders and quadrivalent human papillomavirus vaccination of young female subjects.
Grimaldi-Bensouda L1, Guillemot D, Godeau B, Bénichou J, Lebrun-Frenay C, Papeix C, Labauge P, Berquin P, Penfornis A, Benhamou PY, Nicolino M, Simon A, Viallard JF, Costedoat-Chalumeau N, Courcoux MF, Pondarré C, Hilliquin P, Chatelus E, Foltz V, Guillaume S, Rossignol M, Abenhaim L; PGRx-AID Study Group.
22- Curr Drug Saf. 2014 Mar;9(1):65-8.Human papilloma virus vaccine associated uveitis.
Holt HD, Hinkle DM, Falk NS, Fraunfelder FT, Fraunfelder FW1.
23- Clin Rheumatol. 2013 Sep;32(9):1301-7. Human papillomavirus vaccine and systemic lupus erythematosus.
Gatto M1, Agmon-Levin N, Soriano A, Manna R, Maoz-Segal R, Kivity S, Doria A, Shoenfeld Y.
24- Curr Pharm Des. 2013;19(8):1466-87.Human papillomavirus (HPV) vaccines as an option for preventing cervical malignancies: (how) effective and safe?
Tomljenovic L1, Spinosa JP, Shaw CA.
25- Smith JS, Bosetti C et al. IARC multicentric case-control study. Chlamydia trachomatis and invasive cervical cancer: a pooled analysis of the IARC multicentric case-control study. Int J Cancer 2004 Sep 1; 111(3):431-9