STIMOLI E RISPOSTE: INNESCHI INFETTIVI E COSTITUZIONALISMO IMMUNOGENETICO (HLA)
“ La malattia è una risposta”. A noi, che da anni ci occupiamo di malattie croniche seguendo un ben preciso metodo di studio, questa affermazione appare chiara e, oserei dire, scontata, ma non è così per la classe medica tradizionale, la quale si ostina a interpretare il sistema immunitario esclusivamente come il meccanismo in grado di difendere il nostro organismo dall’assalto di invasori esterni, siano essi virus, batteri o altro. L’entità della malattia dipenderebbe da una parte dall’aggressività dell’invasore, dall’altra da una scarsa efficienza del sistema di difesa. Frasi tipo: ”ti sei ammalato perché le tue difese immunitarie erano basse” sono all’ordine del giorno, anche in bocca a personaggi autorevoli…
Niente di più falso; a parte il fatto che un abbassamento delle difese immunitarie si può manifestare solo in un malato di AIDS, o in individui sottoposti a chemioterapia e/o a terapie con immunosoppressori, è vero proprio il contrario: noi ci ammaliamo quando il nostro sistema immunitario, a contatto con un agente patogeno esterno, lo riconosce come aggressore e tenta di eliminarlo, svolge cioè pienamente la funzione che gli compete, per la quale è stato programmato.
La manifestazione di una patologia in termini più o meno gravi non dipende dal grado di aggressività dello stimolo esterno, né tantomeno dall’inefficienza del sistema difensivo, bensì dalla modalità della risposta individuale.
Ecco perché la malattia è una risposta, perché se il nostro sistema di difesa non riconoscesse l’agente patogeno, non risponderebbe, e l’agente patogeno non esisterebbe più in quanto tale. Perché durante una epidemia di influenza, ad esempio, ci sono persone che non si ammalano, pur entrando in contatto certo con il virus?
Un agente infettivo per diventare patogeno nell’organismo deve potersi legare ad un recettore. Se il recettore non c’è, non c’è patologia, ma anche se c’è non è detto che il sistema sappia “leggerlo”: dipende dal nostro determinante di suscettibilità o di resistenza a quel determinato agente patogeno, dipende dal nostro HLA (Human Leucocyte Antigen).
Sul ramo corto del cromosoma 6, in posizione telomerica, è espresso il nostro sistema di istocompatibilità, HLA appunto, un gruppo di geni che gestisce le risposte del sistema immunitario alle infezioni di virus e batteri. Le lettere maiuscole definiscono i loci, ove si trovano i singoli geni.
Distinguendo tali loci in classi, troviamo:
classe I: A, B, C, E, G;
classe II: DR, DQ, DP.
Nell’ambito dei loci si distinguono, poi, i geni specifici (es.: DR1, DR3, DR4, etc.), i quali si trovano in forma allelica. La tipizzazione sierologica si limita alla distinzione dei geni specifici, mentre quella molecolare, tramite PCR, permette l’identificazione dei singoli alleli, uno materno, l’altro paterno.(es: DR *04,01)
Le molecole codificate dai geni di classe I consistono di una catena pesante Alfa, che si lega a una catena leggera, denominata Beta2-microglobulina
Le molecole di classe II sono eterodimeri, costituiti da una catena Alfa, assemblata a una catena Beta. I geni che codificano per le due catene, dunque, sono diversi, anche se situati nello stesso locus.
L’HLA di classe I, locus A, B e C è presente alla nascita, e consente al neonato di difendersi da aggressioni tumorali e di legare gli antigeni dello Streptococco; l’HLA di classe II, locus DQ e DR, si esprime via via che il bambino entra in contatto con agenti infettivi e assume, cioè, la sua individualità biologica.
La risposta a stimoli esterni, di qualunque natura essi siano (chimici, fisici, infettivi) comprende due fasi, una innata, l’altra acquisita, una non cognitiva, l’altra sì.
La prima è aspecifica, volta ad eliminare lo stimolo estraneo attraverso l’infiammazione, risposta fissa e programmata, uguale per tutti gli individui perché fa parte di un bagaglio genetico dell’intera specie umana, accumulato nei millenni per l’adattamento all’ambiente. E’ la “percezione” di un batterio a distanza da parte di un macrofago o di una cellula dendritica e la successione di eventi a cascata che ne consegue, con produzione e immissione in circolo di citochine. A questa si devono i sintomi prodromici (febbre, artralgia, malessere, cefalea) tipici di qualunque infezione. Per fare un esempio, la sintomatologia d’esordio di un’influenza non è dovuta al virus influenzale, ma alla produzione di una citochina, il TNF. Essendo comune a tutte le infezioni, non è possibile, in questa fase di risposta distinguere la malattia infettiva in corso.
I sintomi di stato compaiono solo nella seconda fase, detta adattativa o specifica, mediante un processo molto più impegnativo, che trova nel linfocita il soggetto principale; questa si realizza solo quando l’antigene viene processato e presentato nel contesto delle molecole HLA da una cellula presentante l’antigene (APC). Fig.3
Tra queste le più importanti sono le cellule dendritiche, di origine centrale midollare, o periferica, monocitaria, cellule molto mobili, dotate di sensori estremamente sensibili all’intercettazione di materiale estraneo, che, entrato in contatto con l’organismo, viene immediatamente “captato” e inglobato nelle cellule stesse, processato, cioè frammentato in una serie di piccoli peptidi che vengono letti da molecole HLA che li presentano alla superficie della cellula, nei linfonodi, al linfocita naif (vergine) che possiede il recettore per quell’antigene. Questo porta alla clonazione di tale linfocita in tanti linfociti uguali, capaci di rispondere allo stesso antigene.
La risposta linfocitaria è individuale, è specifica, cioè risponde ad un solo antigene, e solo a quello. Da qui prenderà il via la risposta umorale o cellulare, a seconda del tipo di antigene che l’ha sollecitata, e si differenzieranno anche quei linfociti depositari della memoria, T o B, che conferiranno uno stato di immunità permanente.
Possiamo affermare, quindi, che il sistema immunitario non è un semplice “sistema di difesa” ma un complesso sistema d’interazione con l’ambiente che ci circonda.
Se non c’è risposta, non c’è malattia; se non c’è risposta vuol dire che mancano le molecole HLA in grado di generarla. In questo caso non è che l’antigene non venga processato, il ruolo della cellula dendritica, o chi per essa, rimane invariato, ma se presenta l’antigene in mancanza di una molecola HLA il linfocita non lo “leggerà”, non ci sarà risposta, e quindi non ci sarà malattia.
Pensiamo solo a quel 10% della popolazione, apparentemente in buona salute, che è “non responder” per l’epatite B. Malgrado dosi ripetute di vaccino antiepatite B non sviluppano Ab anti HBs, perché mancano i presupposti immunogenetici per la lettura dell’antigene nel contesto di quelle particolari molecole HLA che inducono l’attivazione linfocitaria.
L’antigene, poi, può essere presentato da quasi tutte le cellule dotate di nucleo, ivi comprese le cellule bersaglio di determinati antigeni. Tornando all’esempio dell’ Epatite B, il virus entra in circolo, viene intercettato dai monociti circolanti, che diventano cellule dendritiche, internalizzato, processato e presentato al linfocita specifico, che si clona, si attiva.
Ma sull’epitelio della cellula epatica è presente il recettore specifico per il virus, il CD81, che permette all’epatocita di legarlo, processarlo e presentarlo all’esterno della membrana; ecco che i linfociti attivati andranno ad aggredire l’epitelio epatico, dando luogo al danno d’organo, la necrosi epatica, con tutti i sintomi che ben conosciamo.
A questo punto è chiaro che STIMOLO = AGENTE INFETTIVO, RISPOSTA = ATTIVAZIONE LINFOCITARIA.
Le malattie sono acquisite, determinate da una nostra capacità di risposta ad uno stimolo.
Ora, se per una malattia acuta questo binomio stimolo-risposta è abbastanza semplice e direi quasi intuitivo, pensiamo solo alle malattie esantematiche tipiche dell’infanzia, laddove ad uno specifico stimolo infettivo corrisponde una specifica risposta sintomatologica, uguali per tutti gli individui, la questione si complica quando consideriamo una malattia cronica; nella malattia cronica il tempo di latenza tra infezione e risposta può dilatarsi enormemente; tra l’infezione e la manifestazione della malattia possono passare anche decenni. Come può essere possibile? Per quella capacità meravigliosa da un lato e terribile dall’altro, una vera e propria funzione intellettiva, che una parte dei linfociti possiede: la memoria.
Questo è il modello di studio attuale e inedito di una malattia cronica: ad un evento remoto, ben riconoscibile per la sua sintomatologia, fa’ seguito un coinvolgimento clinico sempre più evoluto, che porta, nel tempo, alla manifestazione clinica di una patologia più importante, più grave, molto spesso di tipo autoimmune.
Nella malattia cronica, contrariamente alla malattia acuta, i sintomi si fanno variegati e peculiari, variabili da individuo a individuo. Ma un’approfondita indagine anamnestica consente al medico attento di evidenziare il momento preciso, nella storia clinica del paziente, nel quale si è verificato quello che noi chiamiamo un innesco, che è sempre di origine infettiva e dal quale il fenomeno inizia ad evolvere.
L’indagine anamnestica ha un ruolo chiave nella comprensione del fenomeno patologico cronico, e sgomenta il fatto che la medicina moderna vi presti sempre meno attenzione, abituata ormai ad accettare un arco temporale ampio ed evolutivo nel rapporto causa-effetto solo nella psicologia relazionale.
Buona parte della comunità medica, infatti, e includo anche e soprattutto medici omeopati, non ha difficoltà ad ammettere che un evento remoto, ad esempio un conflitto psichico, possa generare nel tempo fenomeni morbosi anche complessi; le difficoltà insorgono quando si recupera una correlazione infettiva tra sintomi attuali e stimoli remoti.
Per quanto prima enunciato, la nostra costituzione immunogenetica, specifica e individuale (non esistono due HLA uguali, se non in gemelli omozigoti), è un fattore predisponente necessario ma non sufficiente per il determinismo della patologia. Perché questa si manifesti è indispensabile uno stimolo innescante, infettivo, e la cosa straordinaria è che la medicina accademica riconosce questi stimoli, solo che non ne tiene conto, perché dispersi nel tempo, dimenticando che una delle capacità del sistema immunitario è proprio il mantenimento di una memoria, che si traduce in mantenimento di una risposta.
Le malattie croniche sono dovute alla memoria dei linfociti citotossici.
Prendiamo ad esempio la risposta immunitaria contro l’Epstein Barr virus, un virus molto comune, se pensiamo che il 90% circa della popolazione ha sviluppato una mononucleosi, a volte senza neppure rendersene conto, nel corso della vita. Ebbene la risposta anticorpale all’EBV può determinare, nell’ambito di un HLA DR1 e/o DR4, un’Artrite Reumatoide, malattia cronica autoimmune, attraverso un meccanismo di similitudine molecolare tra una glicoproteina del virus (Gp110)e il DR4 stesso, fortemente espresso sulle membrane sinoviali.
QRRAA (DR1-DR4)-----QKRAA(Gp110 capside EBV)
I linfociti attivati dirigono quindi la loro aggressività verso strutture del sé biologico, in questo caso condrociti e sinoviociti, dando luogo alla manifestazione sintomatologica tipica di dolore, rigidità articolare, versamento, culminante nel danno d’organo, l’erosione cartilaginea e la formazione del panno sinoviale.
Il molecular mimicry, ben conosciuto in immunopatologia reumatologica, si basa su un criterio di similitudine strettamente omeopatico.
Questa impostazione permette di comprendere il significato profondo e attuale del modello omeopatico di malattia cronica, per il quale uno stimolo infettivo specifico agirebbe sulle costituzioni individuali, assimilabili all’immunogenetica o HLA, determinando sintomi evolutivi.
Senza addentrarmi in questo discorso, che verrà ampiamente approfondito dalle relazioni che seguiranno, tengo a sottolineare l’importanza fondamentale di un metodo di studio, che consente di affrontare agevolmente qualunque tipo di malattia cronica, considerata dalla medicina accademica con una sorta di ineluttabilità, non solo come possibilità terapeutica, ma anche come possibile prevenzione.
Ad esempio, eliminare una risposta citotossica verso non solo l’Epstein Barr virus, ma anche verso Coli patogeni, Proteus mirabilis, Parvovirus B19, Borrelia Burgdorferi, agenti infettivi che, possedendo tutti una sequenza aminoacidica simile all’HLA DR4, sono potenzialmente in grado di scatenare una risposta autoimmune, in un individuo che non ne ha ancora manifestato i sintomi, perché magari ancora molto giovane, significa prevenire la possibile insorgenza, nel corso della sua vita, di un’Artrite Reumatoide.
Questo è l’obiettivo che la medicina omeopatica riesce a raggiungere: eliminare, quando ancora è possibile, o bloccare l’evoluzione di una malattia cronica, in perfetta sinergia con la medicina accademica, anzi, sfruttando al meglio le informazioni e gli strumenti diagnostici che questa ci offre, secondo quel concetto di medicina integrata che dovrebbe ormai essere universalmente accettato e condiviso.
BIBLIOGRAFIA
1) Abbas, Lichtman e Pillai,
Immunologia cellulare e molecolare,
Milano, Elsevier, VII edizione, 2012
2) Charles A. Janeway, Paul Travers, Mark Walport, Mark J. Shlomchik,
Immunobiologia (3ª edizione italiana)
Padova, Piccin, 2007
3) Immune Netw. 2014 Feb;14(1):7-13.
Potential role of bacterial infection in autoimmune diseases: a new aspect of molecular mimicry.
Alam J1, Kim YC1, Choi Y1.
4) Curr Genomics. 2007 Nov; 8(7): 453–465.
The HLA Region and Autoimmune Disease: Associations and Mechanisms of Action
S.C.L Gough and M.J Simmonds
5) Transpl. Immunol. 2005;14:175–182.
HLA associated genetic predisposition to autoimmune diseases Genes involved and possible mechanisms.
Thorsby E., Lie B.A
6) Curr. Opin. Immunol. 2005;17:624–631.
CD8+ T cells in autoimmunity.
Walter U., Santamaria P.
7) Front Neurol. 2015 Jul 15;6:163.
CD8(+) T Cell-Mediated Neuronal Dysfunction and Degeneration in Limbic Encephalitis.
Ehling P1, Melzer N2, Budde T3, Meuth SG1.
8) Immunol. Lett. 1999;69:301–306.
Genetics of rheumatoid arthritis (RA): two separate regions in the major histocompatibility complex contribute to susceptibility to RA.
Singal D.P., Li J., Lei K.
9) J Immunoassay Immunochem. 2013;34(2):126-33. doi: 10.1080/15321819.2012.690357.
Study of association between HLA-DR4 and DR53 and autoantibody detection in rheumatoid arthritis.
Zhou Y1, Tan L, Que Q, Li H, Cai L, Cao L, Ye Q, Xiong J
10) Immunol Res. 2015 Feb;61(1-2):117-25. doi: 10.1007/s12026-014-8584-2.
In ACPA-positive RA patients, antibodies to EBNA35-58Cit, a citrullinated peptide from the Epstein-Barr nuclear antigen-1, strongly cross-react with the peptide ?60-74Cit which bears the immunodominant epitope of citrullinated fibrin.
Cornillet M1, Verrouil E, Cantagrel A, Serre G, Nogueira L
11) Clin Dev Immunol. 2013; Epub 2013 Aug 24.
Epstein-Barr virus in systemic autoimmune diseases.
Draborg AH1, Duus K, Houen G.
12) Autoimmun. Rev. 2004;3(Suppl 1):S69–71.
Possible involvement of Epstein-Barr virus and its regulatory gene in rheumatoid synovitis.
Sawada S., Takei M.
13) Joint Bone Spine. 2007;74:418–426.
Pathophysiological links between rheumatoid arthritis and the Epstein-Barr virus: an update.
Toussirot E., Roudier J.
14) . Medicina (Kaunas 2015);51(1):18-24.
Use of exploratory factor analysis to ascertain the correlation between the activities of rheumatoid arthritis and infection by human parvovirus B19.
Kakurina N1, Kadisa A2, Lejnieks A3, Mikazane H2, Kozireva S3, Murovska M3.
15) Clin Chim Acta. 2009 Jul;405(1-2):76-82.
Anti-human parvovirus B19 nonstructural protein antibodies in patients with rheumatoid arthritis.
Tzang BS1, Tsai CC, Tsay GJ, Wang M, Sun YS, Hsu TC.
16) J Rheumatol. 2008 Jul;35(7):1265-70. Epub 2008 May 15.
Incidence and clinical significance of parvovirus B19 infection in patients with rheumatoid arthritis.
Kozireva SV1, Zestkova JV, Mikazane HJ, Kadisa AL, Kakurina NA, Lejnieks AA, Danilane IN, Murovska MF.
17) Rheumatol. Int. 2005;26:7
The relationship between arthritis and human parvovirus B19 infection.
Caliskan R., Masatlioglu S., Aslan M., Altun S., Saribas S., Ergin S., Uckan E., Koksal V., Oz V., Altas K., Fresko I., Kocazeybek B.
18) Clin Vaccine Immunol. 2007 Nov;14(11):1437-41. Epub 2007 Sep 19.
Serum reactivity against Borrelia burgdorferi OspA in patients with rheumatoid arthritis.
Hsieh YF1, Liu HW, Hsu TC, Wei JC, Shih CM, Krause PJ, Tsay GJ
19) Rheumatology (Oxford). 2010 Jul;49(7):1311-6
Distinct bacterial colonization patterns of Escherichia coli subtypes associate with rheumatoid factor status in early inflammatory arthritis.
Newkirk MM1, Zbar A, Baron M, Manges AR.
20) Rheumatology (Oxford). 2005 Nov;44(11):1433-41. Epub 2005 Aug 9.
Elevated levels of IgM and IgA antibodies to Proteus mirabilis and IgM antibodies to Escherichia coli are associated with early rheumatoid factor (RF)-positive rheumatoid arthritis.
Newkirk MM1, Goldbach-Mansky R, Senior BW, Klippel J,Schumacher HR JrEl-Gabalawy HS
21) Samuel Hahnemann
Le Malattie Croniche Loro peculiare natura e guarigione omeopatica. Vol.1-2-3
edizione italiana a cura di Angelo Micozzi dall’originale tedesco del 1835
22) Micozzi A.
Immunofarmacologia omeopatica.
Edi-Lombardo. 2000
Date le sempre più numerose richieste da parte dei miei pazienti su come comportarsi nel caos di questa apparentemente interminabile pandemia, voglio prima di tutto rassicurarli: il Sars-CoV2 non è quel "mostro" che i media ci propongono ogni santo giorno ad ogni santa ora. E' un virus molto contagioso, questo sì, come tutti i virus sconosciuti, in grado perciò di infettare un gran numero di persone, ma pur sempre un virus di tipo influenzale, che si può evitare di contrarre con una buona prevenzione e, soprattutto, che si può curare, se preso ai primi sintomi, restando comodamente a casa propria ed evitando così di intasare i Pronto Soccorsi e eventuali ricoveri in zone ad alto rischio aggravamento, quali gli Ospedali. E' a dir poco incredibile che ancor oggi l'AIFA non abbia dato chiare istruzioni ai medici di base per seguire i propri pazienti a domicilio, oggi che è ormai assodato come ci siano farmaci in grado di curare il Covid19. Riassumo perciò di seguito due schemi di terapia, uno preventivo, l'altro curativo: Per prevenire l'infezione: - Anti CD26 06LM P.L. 1 fl. ogni 4 gg - Lattoferrina 200 IMMUNO 1 sticker/die direttamente in bocca - Vit.D 10.000U/I softgels 1/die - Vit.C 1gr/die - Quercetina 1cps/die - Endovirstop spray 8spray distribuiti nell'arco della giornata Terapia ai primi sintomi: - Anti CD26 06LM P.L.(eventualmente seguita dalla 018LM P.L.) 1fl/die - Anti CD13 06LM P.L. 1fl/die - Antiinfiammatori FANS (Oki, Aulin) x2/die o Normast 600mg bustine, 3/die, 1 ogni 8 ore In più, se presenti segni di insufficienza respiratoria o bassa saturazione di O2 - Azitromicina 500mg il 1° giorno, 250mg x i 5 gg seguenti - Plaquenil 200mg x 2/die per qualche giorno
Vi invito a leggere il link sottostante, molto chiaro e di facile comprensione, sulla scoperta della vera causa di morte nei degenti in terapia intensiva per CoVid-19, del tutto inaspettata: tromboembolia polmonare o CID (Coagulazione Intravascolare Disseminata) Ora, l'articolo è esaustivo e per questo lo pubblico, ma sorge spontanea una domanda: perché questo virus dovrebbe indurre una risposta di questo genere, cioè in che modo causerebbe la formazione di trombi? L'autore liquida la questione parlando di "forte infiammazione", per noi la spiegazione potrebbe essere un'altra. Così come succede sempre durante un'infezione virale di tipo influenzale si ha, per immunità eterologa, una riacutizzazione della risposta di memoria ad altri virus, come il CMV, un virus herpetico capace, lui sì, di innescare la cascata coagulatoria. Ecco che allora il rimedio che indicavo nel primo articolo sul Coronavirus, che scrissi in tempi non sospetti, era il 7 Marzo, quando ancora non era dilagata questa pandemia, l'AntiCD13, ora più che mai dimostra la sua validità terapeutica, come prevenzione efficace (perché il CMV condivide con il Coronavirus il recettore CD13), prima che possa instaurarsi il processo di formazione dei trombi. Per approfondire: https://m.facebook.com/story.php?story_fbid=1346956485492478&id=565021547019313
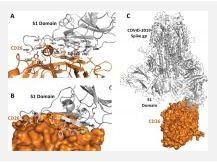
A riprova di quanto ho scritto nell'articolo precedente, ecco di seguito un articolo recentissimo, da PubMed, sulla veridicità di quanto affermo circa il CD26 come recettore del nuovo Coronavirus. Ora più che mai si avvalora il potenziale terapeutico dell'anti CD26 nella risoluzione dell'epidemia che sta dilagando in tutto il mondo, se assunto ai primi sintomi dell'infezione . 2020 Mar 17 eCollection 2020 Emerging WuHan (COVID-19) Coronavirus: Glycan Shield and Structure Prediction of Spike Glycoprotein and Its Interaction With Human CD26 Naveen Vankadari 1 , Jacqueline A Wilce 1 Abstract The recent outbreak of pneumonia-causing COVID-19 in China is an urgent global public health issue with an increase in mortality and morbidity. Here we report our modelled homo-trimer structure of COVID-19 spike glycoprotein in both closed (ligand-free) and open (ligand-bound) conformation, which is involved in host cell adhesion. We also predict the unique N- and O-linked glycosylation sites of spike glycoprotein that distinguish it from the SARS and underlines shielding and camouflage of COVID-19 from the host the defence system. Furthermore, our study also highlights the key finding that the S1 domain of COVID-19 spike glycoprotein potentially interacts with the human CD26, a key immunoregulatory factor for hijacking and virulence. These findings accentuate the unique features of COVID-19 and assist in the development of new therapeutics.
Si è detto che il recettore di questo nuovo Coronavirus sia l'ACE2, un enzima di conversione dell'angiotensina2; e sicuramente è così, in una seconda fase dell'infezione, perché l'ACE2 è molto presente a livello periferico, e permette al virus di penetrare nell'epitelio del sistema respiratorio, cardiaco, intestinale e renale. Ma l'ACE2 non è espresso sulle cellule dendritiche, quelle cellule cioè del sistema immunitario che per prime rispondono all'entrata di un agente patogeno nell'organismo, quindi non può essere il primo recettore, ce n'è un altro, che pensiamo possa essere il DPP4 (quello della MERS) una proteasi espressa sia su cellule dendritiche che periferiche; il DPP4, anche noto come CD26, permette il legame tra virus e cellula dendritica e da qui l'inizio di un lieve stato infiammatorio, i cosiddetti "sintomi di stato", malessere, febbricola, dolori muscolari, raucedine ect.., dovuti all'internalizzazione del virus, la sua processazione nel nucleo della cellula, la sua presentazione all'esterno della membrana: solo a questo punto il linfocita "legge" l'Antigene presentato e si clona il linfocita specifico. E' solo a questo punto che si ha l'entrata negli epiteli periferici, tramite l'ACE2, ma tutto questo ha richiesto del tempo, dai 4 ai 6 giorni, a volte anche 8, durante i quali, se riusciamo a intervenire possiamo bloccare l'evoluzione e l'aggravamento di una sintomatologia. Come fare? Esiste un anticorpo monoclonale, l'AntiCD26, in grado di inibire la trasduzione del segnale infiammatorio, purchè assunto ai primi sintomi, o preso come prevenzione, nella misura di una fl/die, alla 06LM P.L .E' una vera tristezza ed una grossa frustrazione che, pur in assenza totale di farmaci specifici, nessuno prenda in considerazione questa possibilità terapeutica, perché omeopatica, quindi "non scientifica"...
In risposta a chi afferma che i vaccini sono innocui, vi invito a sentire la testimonianza di questo gruppo di ragazzine, alle quali la somministrazione del vaccino anti HPV (Papilloma virus)ha letteralmente sconvolto la vita, facendo insorgere patologie autoimmuni quali la fibromialgia o la tiroidite di Hashimoto, per le quali, poi, la medicina ufficiale non ha terapie efficaci, se non imbottirle a vita di cortisone...che follia! A tutte loro vorrei dire di non perdere la speranza di ritornare ad essere "normali": queste patologie si possono curare con farmaci in grado di sopprimere la risposta citotossica del loro sistema immunitario contro l'HPV. Per approfondire: https://youtu.be/eBLgOe2p4o4
I giudici hanno condannato il ministero a versare un assegno bimestrale, per tutta la vita, a un bimbo affetto da autismo, a cui nel 2006 fu iniettato il vaccino esavalente prodotto dalla GlaxoSmithKline. Nella relazione del medico legale, come riporta Repubblica, si fa riferimento a "un poderoso documento riservato sui side effects del vaccino durante la sperimentazione clinica". Il Ministero della Salute ha proposto appello. 25 NOV - Sentenza clamorosa del Tribunale del Lavoro di Milano che ha condannato il ministero della Salute a dover versare un assegno bimestrale, per tutta la vita, a un bimbo affetto da autismo, a cui nel 2006 fu iniettato il vaccino esavalente prodotto dalla multinazionale GlaxoSmithKline. Come riportato da Repubblica, nella sentenza si richiama "l'acclarata la sussistenza del nesso causale tra tale vaccinazione e la malattia", e ancora, citando la perizia del medico legale Alberto Tornatore nominato dal Tribunale: "È probabile che il disturbo autistico del piccolo sia stato concausato, sulla base di un polimorfismo che lo ha reso suscettibile alla tossicità di uno o più ingredienti (o inquinanti), dal vaccino Infanrix Hexa Sk". Nelle 18 pagine della relazione del medico legale, si fa riferimento a "un poderoso documento riservato della GlaxoSmithKline" sui "cosiddetti side effects del vaccino Infanrix Hexa Sk emersi nel corso della sperimentazione clinica pre-autorizzazione o successivamente, fra l'ottobre 2009 e lo stesso mese 2011". In particolare, ci sarebbero "cinque casi di autismo segnalati durante i trial, ma rimasti unlisted, ossia omessi dall'elenco degli effetti avversi sottoposto alle autorità sanitarie per l'autorizzazione al commercio". Sempre citando le conclusioni del medico legale, nella sentenza si riporta come nel vaccino vi sarebbe "una specifica idoneità lesiva per il disturbo autistico, la cui portata, teoricamente piccola se calcolata in base alla sperimentazione clinica pre-autorizzazione", sarebbe in realtà "sottostimata, per l'esistenza, recentemente confermata dall'autorità sanitaria australiana, di lotti del vaccino contenente un disinfettante a base di mercurio, oggi ufficialmente bandito per via della comprovata neurotossicità". Il Ministero della Salute ha comunicato di aver proposto, per il tramite dell’Avvocatura Distrettuale dello Stato, tempestivamente appello avverso la predetta sentenza dinanzi alla Corte di appello di Milano.

Finalmente anche la medicina convenzionale si sta "accorgendo" di quello che noi sosteniamo da tempo, e cioè l'importanza della tipizzazione genomica DQ2 e DQ8 nello studio della malattia celiaca. Oggi, uno studio* internazionale, svolto da ricercatori italiani e pubblicato su the New England Journal of Medicine (NEJM) su oltre 700 bambini in 20 centri di tutta Italia all’interno dell’Italian Baby Study on Weaning and CD Risk. ha portato indicazioni estremamente importanti circa il ruolo che la genetica svolge nella manifestazione della malattia. Il fattore genetico, individuato dalle molecole HLA del sistema immunitario, aumenta il rischio del bambino di sviluppare la malattia; in tal caso l’introduzione ritardata del glutine, portata dai sei ai dodici mesi, potrebbe avere effetti benefici contro la malattia, riducendone l’impatto sugli organi che si stanno sviluppando. Nei bambini ad alto rischio un'introduzione tardiva attorno all'anno di età riduce sensibilmente il pericolo di celiachia. Perciò sarebbe molto utile riuscire a individuare precocemente questi piccoli. La ricerca è della Società Italiana di Gastroenterologia (Sigenp) coordinata da Carlo Catassi dell'Università Politecnica delle Marche e Alessio Fasano del Center for Celiac Research and Treatment del Massachusetts General Hospital for Children, sostenuta dalla Fondazione Celiachia e finanziata grazie ai fondi del 5 per mille dell'Associazione Italiana Celiachia (AIC). I risultati sottolineano una volta di più come sia possibile e doveroso puntare alla diagnosi precoce, che proprio le mamme celiache sanno quanto sia essenziale per iniziare il percorso verso il benessere: a differenza delle altre malattie,infatti, in cui la diagnosi significa iniziare terapie e trattamenti, scoprire la celiachia significa cominciare da subito a stare meglio e recuperare perfino gli eventuali danni instaurati sulla parete intestinale". “Tra i diversi fattori che abbiamo studiato, è molto chiaro che il background genetico è di gran lunga l’elemento più importante nel determinare quali bambini potrebbero sviluppare questa condizione autoimmune”, ha spiegato Alessio Fasano. Il fattore genetico In base ai dati dati raccolti, il principale fattore di rischio per la celiachia è risultata la presenza di un gene, HLA-DQ2. I bimbi che ne hanno due copie hanno il 38% di probabilità di essere celiaci contro il 19% dei piccoli che non ne sono portatori. Catassi, inoltre, sottolinea che un semplice test del sangue del genotipo HLA potrebbe rapidamente evidenziare i bambini ‘ad alto rischio’, magari nella direzione di mettere in atto strategie di prevenzione primaria.

Pubblico volentieri un comunicato dell'Associazione Culturale Pediatri, diffuso ai medici e alle istituzioni, che, con parole chiare e di buon senso, denuncia finalmente il falso allarmismo e il clima di terrorismo psicologico che in questi giorni i media stanno divulgando tra la popolazione, affinchè i pazienti si rendano conto di quanta cattiva informazione circoli, e, soprattutto, si chiedano quali e quanti interessi economici entrino in gioco ogni qual volta si parli di "vaccinazioni di massa"... LETTERA APERTA AI POLITICI, AI PROFESSIONISTI DELLE SALUTE E AI MEZZI DI COMUNICAZIONE LA POSIZIONE DELL’ASSOCIAZIONE CULTURALE PEDIATRI SULLA NUOVA INFLUENZA A/H1N1 Quello che sappiamo per certo di questo nuovo virus influenzale A/H1N1, è che per ora si è dimostrato meno aggressivo della comune influenza stagionale. Diventa perciò difficile capire perché sia stato dichiarato lo stato di pandemia modificando addirittura i criteri della definizione (è scomparsa ad esempio l’elevata mortalità), come spiega Tom Jefferson della Cochrane vaccines field in un’intervista a Spiegel. Nessuno è però in grado di dire se in futuro questo virus si modificherà e diventerà pericoloso. Il suo comportamento, come quello di tutti i virus, è assolutamente imprevedibile. La bassa mortalità, ossia quanti morti rispetto ai casi, riscontrata finora nei paesi dove l’A/H1N1 è già circolato ampiamente (dello 0,3% in Europa e 0,4% negli USA), potrebbe essere in realtà ancora inferiore perché facilmente diversi casi con sintomi lievi sfuggono alla sorveglianza e alcuni decessi possono essere dovuti ad altre cause presenti e non al solo virus. I sintomi della nuova influenza sono assai generici (febbre, tosse, raffreddore, dolori muscolari, malessere, vomito o diarrea) e, come quelli dell’influenza stagionale, possono essere causati da molti altri virus o batteri. Questo è uno dei motivi per cui il fenomeno “influenzale” nel suo complesso, viene generalmente sovrastimato. I vaccini contro il nuovo virus A/H1N1 sono ancora in fase di sperimentazione. Nessuno è in grado oggi di sapere se e quanto saranno efficaci e sicuri. Ma per diventare aggressivo il virus dovrebbe cambiare (per mutazione? riassortimento con altri virus?), quindi i vaccini mirati al virus attuale, potrebbero non essere utili. Sulla sicurezza sia l’Organizzazione mondiale della sanità (OMS) che l’Agenzia del farmaco europea (EMEA), fanno presente la necessità di un’attenta sorveglianza postmarketing per rilevare eventuali effetti collaterali che potrebbero manifestarsi con l’uso su grandi numeri, anche perché alcuni vaccini sono allestiti con tecnologie nuove. Abbiamo già visto durante la pandemia del 1976, diversi casi di Guillain-Barré (una neuropatia periferica) associati alla vaccinazione di milioni di americani contro un virus anch’esso di derivazione suina. Chi decide di vaccinarsi, dovrebbe firmare un “consenso informato” che illustri con precisione benefici e rischi. Quanto al vaccino contro l’influenza stagionale, recenti studi confermano i dubbi sulla sua efficacia sia nei bambini che negli anziani. E sotto i 2 anni di età, è risultato del tutto inefficace. Non si vedono quindi motivi per offrire la vaccinazione stagionale ai bambini sani, per la quale oltre a tutto, ci dice il Center for Disease Control europeo (ECDC), per prendere decisioni servono informazioni basilari come l’impatto della vera influenza (numero di casi, ricoveri e complicazioni) nelle varie età dell’infanzia. Informazioni che non abbiamo. Riguardo agli antivirali a cui il nuovo virus è risultato sensibile in laboratorio - Oseltamivir (Tamiflu) e allo Zanamivir (Relenza) - non sappiamo quanto siano efficaci “in vivo”. Per ora non abbiamo studi al riguardo. Si sa però che entrambi sono poco efficaci verso l’influenza stagionale e sono già state segnalate resistenze del nuovo virus all’Oseltamivir, in alcuni paesi (Danimarca, Giappone, Cina, USA). Inoltre non va dimenticato che gli antivirali possono dare a volte effetti collaterali importanti. Il 18% dei bambini in età scolare del Regno Unito a cui è stato somministrato l’Oseltamivir in occasione dell’epidemia di A/H1N1, ha presentato sintomi neuropsichiatrici e il 40% sintomi gastroenterici. Gli antivirali vanno quindi usati solo su indicazione medica e solo per casi gravi o persone in cattive condizioni di salute. Sull’uso dei vaccini e degli antivirali, c’è chi come Ernesto Burgio (direttore scientifico di ISDE, Medici per l’ambiente) esprime un’ulteriore perplessità: entrambi potrebbero favorire la mutazione del virus verso ceppi più aggressivi. Cosa fare? Andrà innanzi tutto mantenuta calma e lucidità, di fronte alle notizie allarmanti diffuse quotidianamente dai mezzi di comunicazione. Se i casi di influenza saranno più numerosi del solito o il virus dovesse diventare aggressivo, sarà importante permettere ai medici e alle strutture sanitarie di dedicarsi ai pazienti più gravi. La chiusura delle scuole – con tutte le sue ricadute sociali - potrebbe essere presa in considerazione solo se in futuro dovesse circolare un virus altamente aggressivo (non l’attuale A/H1N1). In tal caso andrebbero chiusi anche tutti i luoghi di ritrovo come i cinema, le discoteche, ecc. Potremo invece mettere in atto da subito le uniche misure che si sono dimostrate efficaci nell’impedire la diffusione di tutti i virus respiratori (come l’H1N1 anche se dovesse cambiare): - lavarsi le mani spesso e accuratamente, con acqua e sapone - ripararsi la bocca e il naso quando si tossisce o si starnutisce (e dopo lavarsi le mani) - evitare di toccarsi occhi, naso e bocca, facili vie di entrata dei virus - stare a casa quando si hanno sintomi di influenza - evitare i luoghi affollati quando i casi di malattia sono molto numerosi L’uso della mascherina è risultato efficace negli ambienti di assistenza sanitaria, mentre per altre circostanze l’efficacia non è stata stabilita. Luisella Grandori Responsabile Gruppo vaccinazioni ACP Michele Gangemi Presidente ACP
